Wir behandeln folgende Therapien:
Schilddrüsenerkrankungen gut- und bösartig
Radiojodtherapie (RJT) bei gutartigen Erkrankungen der Schilddrüse
Die Schilddrüse: Ein kleines, aber wichtiges Organ
Die Schilddrüse ist ein ca. 20g schweres, schmetterlingsförmiges Organ, das an der Vorderseite des Halses unterhalb des Kehlkopfes der Luftröhre aufliegt. Aufgabe der Schilddrüse ist es, aus Jod (Iod) und anderen Bausteinen Hormone herzustellen, zu speichern und über das Blut an den Körper abzugeben. Diese Schilddrüsenhormone regeln vieleStoffwechselvorgänge des Körpers und halten sie im Gleichgewicht.
Sie wirken auf den Energiestoffwechsel und den Sauerstoffverbrauch, die Regulation der Körpertemperatur und des Wasserhaushalts. Außerdem sind sie für die Tätigkeit der Muskeln und des Nervensystems von Bedeutung. Die ordnungsgemäße Funktion des Herzens, des Kreislaufs, des Magen-Darm-Trakts sowie die psychische und die seelische Verfassung hängen wesentlich von der Funktion der Schilddrüse ab. Störungen der Schilddrüsenfunktion haben ganz erhebliche Auswirkungen auf das körperliche und seelische Wohlbefinden des Menschen.
Das Spurenelement "Iod" - seine Bedeutung für die Gesundheit
Damit die Schilddrüse ihre Hormone herstellen kann, braucht sie ausreichend Iod. Die Menge, die täglich von diesem Stoff aufgenommen werden muss, ist geringer als ein Tausendstel Gramm; man zählt deswegen Iod auch zu den Spurenelementen. Liegt die tägliche Iodaufnahme deutlich unterhalb der von der Weltgesundheitsorganisation empfohlenen optimalen Menge von 0,2 Milligramm (1 Milligramm = 1 Tausendstel Gramm), so kommt es über kurz oder lang zu Iodmangelkrankheiten. Beim ungeborenen Kind und dem Kleinkind kann sich der Iodmangel als Entwicklungsstörung äußern. Die häufigsten Symptome des Iodmangels beim Erwachsenen sind die Schilddrüsenvergrößerung und bestimmte Formen der Schilddrüsenüberfunktion.
Schilddrüsenüberfunktion und –vergrösserung: Häufige Jodmangelkrankheiten
Die Schilddrüse kann den Mangel des wichtigen Hormonbausteins Iod in bestimmten Grenzen dadurch ausgleichen, indem sie sich vergrößert. Es entsteht ein Kropf, der das auffälligste Zeichen dafür ist, dass mit der Schilddrüse etwas nicht in Ordnung ist. Der Kropf ist meistens zunächst weich und verursacht kaum Beschwerden. Wird ein Kropf nicht rechtzeitig behandelt, können sich Knoten bilden und Nachbarorgane wie z.B. die Luftröhre beeinträchtigt werden. Bei den Knoten unterscheidet man so genannte „kalte“ Knoten, die vermindert arbeitendes Schilddrüsengewebe enthalten, von „heißen“ Knoten, bei denen der Hormonstoffwechsel auf Hochtouren läuft.
Ist der „heisse“ Knoten gross - oder liegen mehrere heisse Knoten vor – können sich die typischen Zeichen einer Schilddrüsenüberfunktion einstellen: Erhöhter Blutdruck, Herzrasen bzw. beschleunigter Puls, verstärkte Nervosität, Gewichtsabnahme, Durchfälle, Schwitzen. Ein Kropf mit „heissem“ Knoten bedarf in der Regel dringend einer Behandlung entweder durch Operation oder mit Radiojod: Schilddrüsenhemmstoffe als Tropfen oder Tabletten können nur vorübergehend helfen!
Morbus Basedow: Eine besondere Form der Schilddrüsenüberfunktion
Bei der von dem Merseburger Arzt C.A. von Basedow 1840 erstmals beschriebenen Form der Schilddrüsenüberfunktion handelt es sich um eine so genannte Autoimmunerkrankung. Durch eine Störung des Immunsystems werden Antikörper produziert, die die Schilddrüse zur vermehrten Abgabe von Schilddrüsenhormonen anregen. Bei etwas mehr als der Hälfte der Basedow-Patienten kommt es auch zum Exophthalmus, d.h. dem Hervortreten der Augäpfel. Bei der Basedow-Hyperthyreose führt man üblicherweise zunächst einmal eine medikamentöse Therapie mit Schilddrüsenhemmstoffen über einen Zeitraum bis zu einem Jahr durch. Häufig kommt es dabei zu einer so genannten „Spontanremission“ der Erkrankung. Falls die Schilddrüsenüberfunktion aber fortbesteht, ist die Radiojodtherapie neben der Schilddrüsenoperation eine erprobte Methode zur dauerhaften Beseitigung der Basedow-Hyperthyreose (siehe folgende Abbildungen).
Zum Ablauf der Radiojodtherapie
Voruntersuchungen
Nachdem die Notwendigkeit einer Radiojodtherapie bei Ihnen festgestellt wurde, sollten Sie sich jodarm ernähren (z.B. Seefisch, Iodsalz vermeiden). Sie sollten insbesondere darauf achten, keine jodhaltigen Medikamente (z.B. Röntgenkontrastmittel, Vitaminpräparate, Salben oder Augentropfen) zu verwenden. Zunächst ist es erforderlich, die genaue Art Ihrer Schilddrüsenerkrankung festzustellen. Hierzu sind meist eine Bestimmung der Schilddrüsenhormonwerte im Blut, eine Ultraschalluntersuchung sowie ein Szintigramm Ihrer Schilddrüse erforderlich. Einige Tage vor der Behandlung muss noch der so genannte Radiojodtest durchgeführt werden.
Radiojodtest
Diese Untersuchung wird ambulant durchgeführt. Zur Vorbereitung dürfen Sie mindestens 4 Stunden vor dem Test nichts mehr essen. Die ambulante Untersuchung zur Bestimmung des Speicherverhaltens der Schilddrüse dauert zunächst ca. 30-45 Minuten. Nach 2 Stunden ist jedoch zusätzlich eine Messung und (manchmal) die Aufnahme eines Schilddrüsenszintigramms erforderlich (Dauer ca. 15 Minuten). Weitere Messungen folgen 24 und 48 Stunden nach Schlucken der Testkapsel (Dauer je 15 Minuten). Aus dem Messergebnis und der Ultraschalluntersuchung kann nun die optimale Menge an Radiojod, die zur Behandlung Ihrer Schilddrüsenerkrankung erforderlich ist, berechnet werden.
Radiojodtherapie (RJT) bei bösartigen Erkrankungen der Schilddrüse
Bei Ihnen wurde bei einer Operation der Schilddrüse ein bösartiger Tumor dieses Organs gefunden, daher sind Sie zur Durchführung einer Radiojodtherapie zu uns überwiesen worden. Wir möchten Ihnen hier Informationen über die Erkrankung und Ihre weitere Behandlung geben. Bei Rückfragen stehen wir Ihnen gerne zur Verfügung.
Wie wird Schilddrüsenkrebs behandelt?
Bei der Behandlung des Schilddrüsenkrebses (auch Karzinom genannt) sind Ärzte mehrerer Fachrichtungen beteiligt. Die primäre Therapie ist chirurgisch, wobei beim sogenannten differenzierten Schilddrüsenkrebs (papilläre und follikuläre Karzinome) die komplette Entfernung der Schilddrüse der Regeleingriff ist. Nur beim unifokalen papillären Karzinom bis zu einem Durchmesser von weniger als 1 cm und ohne Absiedelungen in Lymphknoten oder in anderen Körperteilen, reicht aufgrund der guten Prognose die operative Entfernung des betroffenen Schilddrüsenlappens aus. Bei allen anderen bösartigen differenzierten Tumoren der Schilddrüse (medulläres Schilddrüsenkarzinom) wird ebenfalls nur eine Operation zur Entfernung der Schilddrüse durchgeführt. Bei entdifferenzierten bösartigen Schilddrüsentumoren wird nach der operativen Entfernung der Schilddrüse meist eine Strahlentherapie des Halses und eventuell eine Radioiodtherapie angeschlossen.
Ziel der Radioiodtherapie
Da es operativ kaum möglich ist, die Schilddrüse komplett zu entfernen, verbleibt bei jeder Schilddrüsenoperation ein mehr oder weniger kleiner Schilddrüsenrest, der mit der Radioiodtherapie vollständig beseitigt werden soll. Es ist möglich, dass hierfür mehrere Radiojodtherapien notwendig sind. Auch bei Wiederauftreten des Tumors im Bereich des operierten Areals am Hals oder bei Tochterabsiedlungen in Lymphknoten oder in anderen Organen wird diese Therapie (erneut) angewandt. Voraussetzung ist jedoch eine Aufnahme des Iod-131 in die bösartige Zelle, dokumentiert in der abschliessend durchgeführten Szintigraphie des Halses und des gesamten Körpers.
Wie wirkt die Radiojodtherapie?
Radioaktives Iod-131 wird in Kapselform gegeben und über den Magen und das Blut in den Schilddrüsenrest aufgenommen und zerstört die nach der Operation noch verbliebenen Schilddrüsenzellen. Damit diese Therapie bestmöglich wirkt, ist eine deutliche Schilddrüsenunterfunktion zum Zeitpunkt der Therapie notwendig. Deshalb sollten im Regelfall nach der Schilddrüsenoperation keine schilddrüsenwirksamen Medikamente verordnet und eingenommen werden und 2 bis 3 Wochen nach der Operation eine Vorstellung bei einer nuklearmedizinischen Abteilung mit Therapiestation erfolgen. Falls der verbliebene Schilddrüsenrest zu groß ist, muß möglicherweise eine Nachoperation durchgeführt werden. Der Wirkungseintritt der Radioiodtherapie erfolgt nicht sofort. Bis zur vollen Wirkung können 4-6 Wochen, unter Umständen bis zu 3 Monate vergehen. Die überwiegend kurz reichende Strahlung (max. 2mm) des Iod-131 wirkt fast ausschließlich in den verbliebenen Schilddrüsenzellen. Ein geringer weiter reichender Anteil der radioaktiven Strahlung dient nach der Therapie zur Durchführung einer Ganzkörperszintigraphie um eine Therapiekontrolle zu haben und eventuell außerhalb der Schilddrüse vorhandene Tochterabsiedelungen zu finden, zu dokumentieren und mittels Operation oder/und Radioiodtherapie weiter zu behandeln.
Bei welchem Schilddrüsenkrebs wird die Radiojodtherapie durchgeführt?
Bei allen Formen des differenzierten papillären und follikulären Schilddrüsenkarzinoms mit Ausnahme des unifokalen papillären Karzinoms mit einem Durchmesser kleiner 1 cm.
Aus welchen Gründen wird die Radiojodtherapie nicht durchgeführt?
Bei Schwangeren wird diese Therapie in keinem Fall angewandt. Bei noch stillenden Müttern ist Abstillen notwendig. Bei Kindern und Jugendlichen mit Schilddrüsenkrebs wird eine Radiojodtherapie (im jüngeren Alter eventuell mit Begleitung eines Elternteils auf Station) mit einer dem Alter angepassten Menge an Radiojod durchgeführt. Zudem muss bei mancher Sonderform des bösartigen Schilddrüsentumors und auch beim entdifferenzierten Schilddrüsenkrebs in der Regel von einer fehlenden Wirksamkeit der Radioiodtherapie ausgegangen werden. Beim medullären Schilddrüsen-Karzinom erfolgt ebenfalls keine Radiojodtherapie.
Wann wird die Radioiodtherapie durchgeführt?
Die erste Radiojodtherapie zur Entfernung der verbliebenen Restschilddrüse erfolgt etwa 4-6 Wochen nach der Operation der Schilddrüse. Bis zu diesem Zeitpunkt liegt auch eine deutliche Verminderung der Schilddrüsenhormone im Blut vor. Diese Verminderung ist für die Durchführung der Radioiodtherapie notwendig. Aus diesem Grund dürfen nach der Operation und vor der geplanten Radiojodtherapie keine Schilddrüsenhormone, jodhaltige Medikamente oder iodhaltige Kontrastmittel gegeben werden. Auch vor eventuell notwendigen Folgeradioiodtherapien muß das zwischenzeitig eingenommene Schilddrüsenhormonpräparat 4 Wochen vorher abgesetzt werden.
Wie wird die Radioiodtherapie durchgeführt?
Vorbereitung
4 Wochen vor der Radioiodtherapie muß eine eventuell gegebene Schilddrüsenhormonmedikation abgesetzt werden. Bei der ersten Radioiodtherapie wird mittels Ultraschall die Größe des verbliebenen Restschilddrüsengewebes bestimmt. Unmittelbar und auch in den ersten beiden Wochen nach Operation kann diese Bestimmung durch noch vorhandene kleinere Einblutungen und beginnende Narbenbildung erschwert sein. Als weitere Methode zur Beurteilung der Größe des Restschilddrüsengewebes dient der Radioiodtest mit einer kleinen Menge an I-131 und eine Szintigraphie des Halses mit Technetium-99m. Bei der Messung der Aufnahme des I-131 nach 24 Stunden sollten 2% nicht überschritten werden. Andernfalls muß eine erneute Operation in Erwägung gezogen werden. Zur Vorbereitung gehört selbstverständlich auch ein ausführliches Gespräch des Arztes mit dem Patienten über bereits erfolgte und geplante Untersuchungen der Schilddrüse, die Medikation, nicht erwünschte Folgen und Nebenwirkungen der Operation sowie verschiedene Blutuntersuchungen. Bei Folgeradioiodtherapien werden ähnliche Voruntersuchungen durchgeführt, ein Radioiodtest ist jedoch nicht mehr notwendig. Bereits beim ersten Gespräch wird der Patient über die Notwendigkeit der lebenslangen Nachsorge mit regelmäßigen Kontrollen der Schilddrüsenhormonparameter im Blut und der lebenslangen Einnahme von Schilddrüsenhormonen informiert.
Aufklärung
Vor der ersten Radioiodtherapie wird der Patient über das Behandlungskonzept (erste Therapie, evtl. notwendige Folgetherapie/n, Therapiekontrollen am Ende jeder Radioiodtherapie mittels Posttherapieszintigraphie und mit einer diagnostischen Ganzkörperszintigraphie 3-6 Monate danach, Bestimmung des Tumormarkers Thyreoglobulin, Sonographie des vorderen Halsbereichs) und die von verschiedenen Faktoren abhängige Dauer des stationären Aufenthaltes bei der Radioiodtherapie von 3-5 Tagen (in Einzelfällen auch bis zu 10 Tagen), informiert. Vor der Therapie wird über die möglichen Nebenwirkungen gesprochen (siehe unten) und eine Schwangerschaft durch einen Schwangerschaftstest ausgeschlossen. Bis zum Abschluß der Behandlung und zur Sicherheit auch noch 4-6 Monate nach der letzten Radioiodtherapie sollte ggf. unbedingt eine geeignete Schwangerschaftsverhütung erfolgen. Zur Information über die Besonderheiten des Aufenthaltes auf der Therapiestation erhält der Patient/in eine Informationsschrift, kann jederzeit Fragen stellen und bestätigt sein Einverständnis zur Durchführung der Therapie per Unterschrift auf einem standardisierten Aufklärungsbogen.
Risiken und Nebenwirkungen
Zu den möglichen Nebenwirkungen der hochdosierten Radioiodtherapie gehören die vorübergehende Entzündung der Schilddrüsen- und Tumorreste, eine vorübergehende Entzündung der Speicheldrüsen und der Magenschleimhaut und eine meist passagere Veränderung des Blutbildes speziell der weißen Blutkörperchen. Diese meist gering ausgeprägten Beschwerden können mit entsprechenden entzündungshemmenden Maßnahmen (z.B. Eiskrawatte), oder Medikamenten gut behandelt werden. In den ersten Tagen der Radioiodtherapie ist besonders auf eine ausreichende Flüssigkeitszufuhr und vorbeugend auf eine Anregung des Speichelflusses mit Kaugummi, Zitronenschnitze und sauren Bonbons zu achten. Blutbildkontrollen sind ggf. notwendig, die vollständige dauerhafte Erniedrigung der weißen Blutkörperchen wurde bisher jedoch sehr selten beobachtet. Die häufigste langfristige Nebenwirkung der hochdosierten Radioiodtherapie ist eine deutliche dauerhafte Einschränkung der Speichelproduktion vor allem der Ohrspeicheldrüsen (10-20%). Bei Patienten mit Tochterabsiedlungen in der Lunge kann es in Folge von wiederholten hochdosierten Radioiodtherapien zu Fibrosierungen (Vernarbungen) des Gewebes kommen. Bei Männern wird selten bei Hochdosistherapien eine eingeschränkte Spermienproduktion beobachtet. Hinweise auf Strahlenwirkungen wie vermehrte Mißbildungen oder andere negative Auswirkungen bei Schwangerschaften nach durchgeführter Radioiodtherapie gibt es nicht.
Durchführung
Am Tag der Therapie wird nach einer mindestens sechsstündigen Nüchternheit meist in der Morgenzeit die Radioiodtherapie oral in Kapselform durchgeführt, eine Stunde danach wird ein Essen angeboten. Bei der ersten Radioiodtherapie werden in unserer Abteilung Dosierungen von 1-4 GBq I-131gewählt und bei Folgetherapien im Einzelfall höhere Aktivitäten gegeben. Grundsätzlich erfolgt die Aktivitätsgabe den individuellen Erfordernissen entsprechend. Tägliche Messungen der im Patienten verbliebenen Aktivität dienen zur Beurteilung des Dosisabfalls und der Berechnung des möglichen Entlassungszeitpunktes. Zudem spielen Maßnahmen zur Vorbeugung und Minimierung der möglichen therapiebegleitenden Nebenwirkungen eine wichtige Rolle. Die abschließende Posttherapieszintigraphie wird üblicherweise direkt mit Ihnen entweder am KSA oder KSB vereinbart. Zu beachten ist, dass Patienten in der Schilddrüsenunterfunktion nicht selbstständig Auto fahren oder Maschinen bedienen sollten.
Was kommt nach der Radioiodtherapie?
Der erfolgreiche Abschluss der ersten Radioiodtherapie des differenzierten Schilddrüsenkarzinoms wird typischerweise durch eine unauffällige Ganzkörperszintigraphie und einem nicht mehr messbaren Thyreoblobulinwert belegt. Nach der ersten Radioiodtherapie folgen regelmäßige Nachsorgeuntersuchungen, die konsequent und lebenslang durchzuführen sind. Die Ziele der Nachsorge liegen in der Suche nach wiederauftretenden Karzinomen bzw. Tochtergeschwülste mittels körperlichen Untersuchung, dem Gespräch mit dem Arzt, der Sonographie des Halses und der Kontrolle der Laborparameter (insbesondere des Tumormarkers Thyreoglobulin) sowie mit verschiedenen Möglichkeiten der Szintigraphie (diagnostische I-131-Ganzkörperszintigraphie, MIBI-SPECT, FDG-PET) und Röntgenuntersuchungen (z.B. Übersichtsaufnahme des Brustkorbs, Computertomographie) oder auch Kernspintomographie. Weiterhin muß die Schilddrüsenhormon-Medikation durch Kontrolle der Laborwerte regelmässig überwacht werden. Hierbei wird (bis auf die Ausnahme des prognostisch günstigen unifokalen papillären Schilddrüsen-Karzinoms mit einem Tumordurchmesser unter 2 cm) ein TSH-Wert von 0,1 oder kleiner (Norm: 0,3 - 4,0 mU/l) angestrebt. Hierfür sind in der Regel Levothyroxin-Dosierungen von 2,5 μg/Kg/KG täglich notwendig. Bei den evtl. nicht radikal operierten papillären Schilddrüsen-Karzinomen unter 1cm ist ein TSH-Wert von 0,3-1,0 mU/l ausreichend. Geachtet wird auch auf Therapiekomplikationen. So werden Patienten mit einer operativ oder postoperativ bedingten Lähmung des Stimmbandes frühzeitig einer logopädischen Behandlung zugeführt. Bei Patienten mit einem postoperativen Mangel an Parathormom (von der Nebenschilddrüse produziertes Hormon) erfolgt eine regelmäßige Kontrolle der Laborwerte ggf. unter Vitamin-D-Medikation.
Neuroendokrine Tumore
Therapie von Neuroendokrinen Tumoren mit Lu-177 DOTA-Peptide
Neuroendokrine Tumor können durch eine innere Bestrahlung mittels Lutetium–177 (177Lu) DOTATATE behandelt werden.
Was ist ein neuroendokriner Tumor?
Jeder Mensch hat neuroendokrine Zellen im Körper. Neuroendokrine Zellen befinden sich hauptsächlich diffus verteilt im Magen–Darm-Trakt, in den Lungen sowie in der Bauchspeicheldrüse. Von diesen Zellen ausgehende Tumore werden unter dem Begriff „neuroendokrine Tumore“ (NET) zusammengefasst. Die Aufgabe dieser Zellen ist die Produktion von verschiedenen Botenstoffen (Hormonen).
Zellen im menschlichen Körper erneuern sich regelmässig und müssen sich dafür teilen. Kommt es bei einer Teilung einer neuroendokrinen Zelle zu einem Fehler kann daraus ein Neuroendokriner Tumor entstehen. Durch den Verlust von Erbinformationen, kommt es zu einer vermehrten Zellteilung und einem Verlust der Selbstregulation.
Dies führt zu einem übermässigen Wachstum und verdrängt normale Zellen in der Umgebung. Glücklicherweise haben neuroendokrine Zellen im Vergleich zu anderen Tumorarten meistens ein langsames Wachstumsverhalten. Neuroendokrine Tumorzellen produzieren häufig Botenstoffe (Hormone).
Der hohe Hormonspiegel führt dann zu Symptomen die man malignes Karzinoid-Syndrom nennt. Oft sind es diese Symptome die zur Diagnose eines Neuroendokrinen Tumors führen: Wärme Schwankungen, hochroter Kopf, Durchfall, Alkoholunverträglichkeit, Asthma oder Hautprobleme.
Wie wird ein neuroendokriner Tumor diagnostiziert?
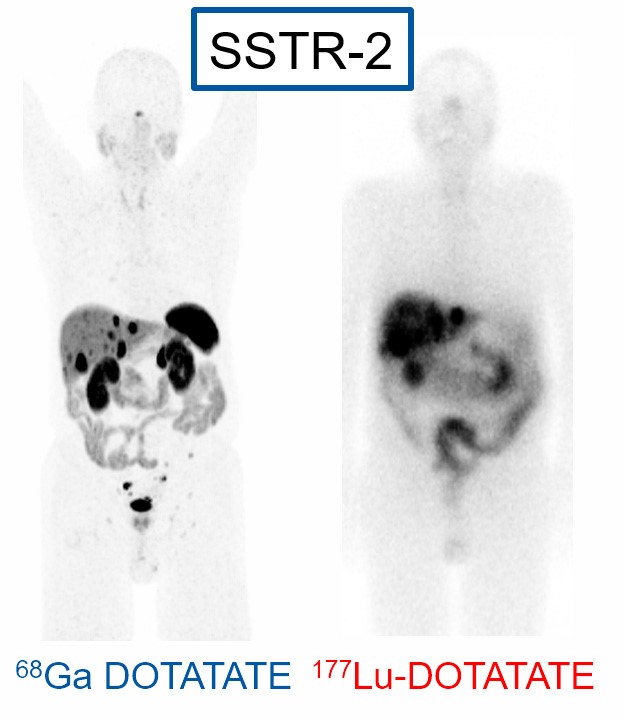
Besteht ein Verdacht auf einen Neuroendokrinen Tumor wird primär eine Computertomographie durchgeführt. Ist diese nicht zielführend wird mittels einer 68Ga-DOTATATE PET/CT nach Zellen mit vermehrter SSTR-2 Expression gesucht. Die SSTR2-Expression ist eine wichtige Eigenschaft von neuroendokrienen Zellen die man sich für die Diagnose und die Therapie zunutze machen kann.
Ist der Tumor nicht mehr auf ein Organ beschränkt, sondern hat bereits mehrere Ableger im Körper, kann man ihn operativ nicht mehr kontrollieren. Viele Patienten sprechen dann über eine lange Zeit gut auf eine Blockade der Somatostatin (SSTR-2) Rezeptoren an (z.B. Somatuline). Zeigt sich darunter ein erneuter Anstieg ist die interne Radiotherapie mit 177Lu-DOTATATE der nächste Schritt.

Wie funktioniert die Lutetium –177 DOTATATE Therapie?
Das Molekül DOTATATE bindet, ähnlich wie das Somatuline an die bereits oben erwähnten SSTR-2 Rezeptoren, welche auf der Zelloberfläche dieser Tumore in einer grosse Anzahl vorkommen. In der Nuklearmedizin nutzt man diese Rezeptoren an den Zelloberflächen doppelt – mit Ga-68 für die Lokalisation und mit 177Lu für die interne Bestrahlung. Diese Peptid-Radiorezeptortherapie (PRRT) mit 177Lu-DOTATATE, bringt die radioaktive Strahlung (ß-Strahlung) direkt zu den Tumorzellen um dort die gezielte therapeutische Wirkung zu entfalten. 177Lu-DOTATATE wird intravenös über ca. 10 min langsam gespritzt und befindet sich innerhalb von Minuten an den Tumorzellen.
Wie ist der Therapieablauf?
Zuerst erhalten Sie ein Aufklärungsgespräch durch den behandelnden Nuklearmediziner. Das 177Lu-DOTATATE wird Ihnen mittels eines Perfusors langsam über 10 Minuten injiziert. Danach müssen die Patienten für 48h auf der Station verbleiben (Strahlenschutzgesetzt des BAG). Am 2. Tag wird eine quantitative SPECT/CT durchgeführt. Damit kann man die Verteilung des Therapeutikums bestimmen, abschätzen ob andere Organe zu viel Dosis bekommen haben und den Verlauf der Erkrankung abschätzen. Wenn alles gut verläuft kann diese Therapie in einer ersten Runde viermal durchgeführt werden, immer im Abstand von ca. 8 Wochen.
Risiken und Nebenwirkungen
Das Risiko für das Erfahren von Nebenwirkungen bei dieser Bestrahlung ist gering. Die meisten Patienten verspüren keine Beeinträchtigungen. Das radioaktive Teilchen Lutetium–177 strahlt nur in einem Umkreis von 4mm. Es strahlt also grösstenteils nur im Tumor. 177Lu-DOTATATE wird wie Aminosäuren auch zu einem Teil von den Nieren aufgenommen. Damit es zu keinen Nierenschädigungen kommt, muss die Niere für das "DOTATATE" blockiert werden. Dies geschieht durch das intravenöse Verabreichen von einer Aminosäurelösung. Diese ist sehr gut verträglich.
Trotzdem ist die 177Lu-DOTATATE Therapie mit einem geringen Risiko einer Nierenschädigung behaftet. Die kann in ganz seltenen Fällen bis hin zu einer Dialysepflicht führen. In Studien trat dies allerdings weniger als bei einem halben Prozent auf. Meist handelte es sich um Patienten mit vorbestehender Nierenerkrankung.
Was kann man von der Therapie erwarten und was sagt die Wissenschaft bisher?
Die Ansprechraten auf die Therapie nach den Kriterien der Welt-Gesundheits- Organisation (WHO) waren wie folgt: Komplette Rückbildungen der Tumore (CR) in 2%, Rückbildungen um mehr als 50% des Volumens (PR) in 22%, leichtgradige Rückbildungen (Tumorrückbildung < 49% und> 25%) in 12%, stabiles Tumorverhalten (SD) in 49% und eine Tumorvergrößerung (PD) in 15% der Patienten. Insgesamt wurde nach WHO-Kriterien eine Tumorantwort (alle Tumorrückbildungen> 50%) in 24% der Fälle nachgewiesen, bei endokrinen Pankreastumoren sogar 36%. Unter Einbezug leichtgradiger Rückbildungen (MR) errechnet sich für das Gesamtkollektiv eine Tumorantwort von 37%. Dieser Zustand hielt in dieser Studie mindestens 9 Monate nach Abschluss der Therapie an. Bei Patienten mit "Malignem Karzinoid Syndrom" konnte eine deutliche subjektive Besserung der Symptomatik festgestellt werden. Alle Patienten mit morphinbedürftigen Schmerzen konnten zu nicht morphinhaltigen Schmerzmitteln wechseln oder ganz auf eine Schmerzmedikation verzichten.
Rechtliches und Kosten
Die Behandlung entspricht den schweizerischen Gesetzen auf Bundes- und Kantonsebene. Die Kosten werden bei den Schweizer Patienten in den meisten Fällen durch die Krankenkasse abgedeckt. Die meisten ausländischen Krankenkassen übernehmen ebenfalls die Kosten der Therapie.
Prostatakarzinom
Therapie von metastasierten Prostata-Tumoren mit Lutetium-177-PSMA
Diese Therapie wird bei Patienten mit einem metastasierten Prostatakarzinom angewendet, bei denen sich die Krankheit trotz Hormontherapie / Chemotherapie weiterentwickelt hat. Das Target dieser Behandlung das sogenannte Prostataspezifisch Membran Antigen (PSMA) ist ein Rezeptor, der v.a. bei aggressiven Prostatakarzinomen vermehrt auf der Oberfläche vorkommt. Dies sowohl im Primären Tumor als auch in den Metastasen, damit kann diese Therapie auch Metastasen in den Lymphknoten- oder in den Weichteilen angehen. Diese Therapie wird aktuell primär dann angewendet, wenn keine andere Möglichkeit mehr besteht das Tumorleiden zu mindern. Es laufen aber Studien (unter anderem auch am KSB) für Patienten in einem früheren Tumorstadium.
In den bisher vorliegenden Studien zeigte die Lutetium-177 (177Lu)-PSMA-617 Therapie gute Erfolge bei akzeptablen Nebenwirkungen, trotz der Anwendung bei Patienten mit weit fortgeschrittener Tumorerkrankung. Mögliche Nebenwirkungen sind v.a. eine Mundtrockenheit, die sich meist aber wieder verbessert, eine Beeinträchtigung der Nierenfunktion, oder des Blutbildes.
Wer wäre für eine Lutetium-177 PSMA Therapie geeignet?
Besteht der Verdacht auf eine erneute Progression unter Chemotherapie bei metastasierten Patienten die nicht mehr auf Hormone ansprechen, wird eine 68Ga-PSMA-11 PET/CT Untersuchung durchgeführt. Hier bekommen die Patienten eine geringe Menge der diagnostischen Variante dieser Substanz, mit welcher man bestimmen kann, ob die Metastasen das PSMA wirklich vermehrt exprimieren oder nicht. Ist dies der Fall und besteht kein Verdacht auf grössere, PSMA-negative Tumorareale kann man eine 177Lu-PSMA-617 Therapie erwägen.
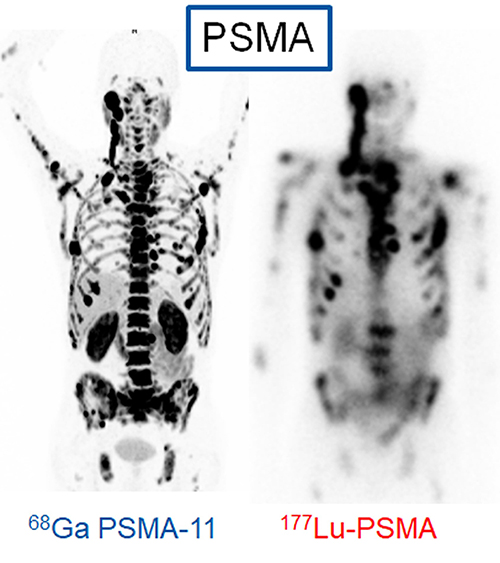
Wie funktioniert die Lutetium-177 PSMA Therapie?
Die Therapie wird stationär auf einer Therapiestation in der Nuklearmedizin durchgeführt. Da sich das 177Lu-PSMA in den Speicheldrüsen anreichert, werden diese geschont, indem eine Kühlung 30 Minuten vor der I.V Verabreichung des 177Lu-PSMA bis zu 4 Stunden nach der Applizierung der Substanz mit speziellen Cool-Packs durchgeführt wird. Durch die Kühlung wird die Durchblutung reduziert, was die Anreicherung des 177Lu-PSMA und damit die e.v. resultierende Mundtrockenheit reduziert. Um die Nieren zu schonen werden Flüssigkeitsinfusionen direkt über die Vene verabreicht, dies fördert die Ausscheidung.
Nach der Injektion sind die Patienten für 48h auf unserer Therapiestation. Dies wird vom Strahlenschutzgesetzt so gefordert. Während des stationären Aufenthaltes dürfen Sie auf der Therapiestation keinen Besuch empfangen. Sie können aber telefonieren und haben Zugang zum Internet.
Am 2. Tag nach der Injektion wird eine quantitative SPECT/CT durchgeführt. Damit kann man die Verteilung des Therapeutikums bestimmen, abschätzen ob andere Organe zu viel Dosis bekommen haben und den Verlauf der Erkrankung abschätzen. Wenn alles gut verläuft kann diese Therapie sechsmal durchgeführt werden, immer im Abstand von ca. 6-8 Wochen.
Bei gutem Ansprechen können Therapiezyklen auch nach hinten geschoben werden.
Komplikationen und Nebenwirkungen der Therapie
Die bisherigen Ergebnisse zeigen, dass keine schwerwiegenden, akuten Komplikationen zu befürchten sind. Es wurde bisher vor allem eine temporäre Mundtrockenheit, eine leichte Übelkeit, selten mit Erbrechen und eine Reduktion der Nierenfunktion oder des Blutbildenden Knochenmarks beschrieben. Deshalb werden alle unsere Patienten regelmässig von Ihren Onkologen und den Ärzten der Nuklearmedizin kontrolliert und begleitet.
Was kann man von der Therapie erwarten und was sagt die Wissenschaft bisher?
Die Datenlage ist noch sehr geringe. Gerade wurden die ersten Daten einer Phase III Studie bekannt gegeben, welche die bisherigen Ergebnisse bestätig hatte mit einem PSA Ansprechen von mehr als 50% in 46% der Patienten und einer Verlängerung des progressionsfreien Überlebens von 3.6 auf 8.8 Monate im Vergleich zur Standardtherapie. Eine Heilung ist mit dieser Therapie nicht zu erwarten.
Rechtliches und Kosten
Die Behandlung ist in der Schweiz noch nicht offiziell zugelassen. D.h. es muss für jede Therapie ein Antrag für «Compassionate use» eingereicht werden. Diesem wird aber in aller Regel stattgegeben. Auf die Patienten kommen keine zusätzlichen Kosten zu.
Unsere Themen im Blog
Blog
Schilddrüsenüberfunktion:
Beschwerdefrei dank Radiojodtherapie

Blog
Radioaktive Strahlung
gegen Krebs

